양극(Anode)과 음극(Cathode) vs. 양극재(Cathod material)와 음극재(Anode material)
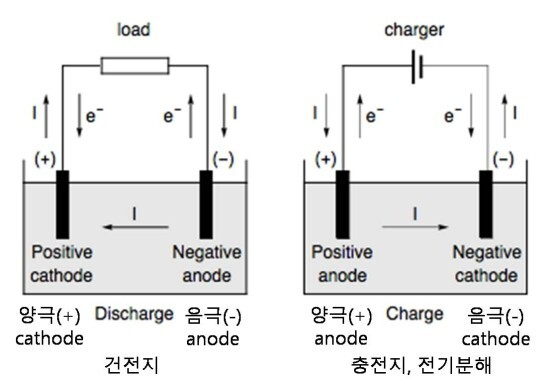
일반적으로 Anode는 양극(+), Cathode는 음극(-)으로 해석되며, 이것은 전기분해의 매커니즘과 일치합니다.
그러나 배터리(건전지/전지)에서는 반대로 Anode는 음극(-), Cathode는 양극(+)으로 해석됩니다.
이것은 애노드와 캐소드를 전위가 높은쪽을 양극(+), 낮은쪽을 음극(-)으로 정의하는 것이 아니라, 위의 그림처럼 애노드는 전류가 흘러 들어올때, 캐소드는 전류가 흘러 나갈때를 기준으로 정의하기 때문입니다.
충전지(충전기)나 전기분해에서는 +에서 산화, -에서 환원이 일어나며, 건전지에서는 +에서 환원, -에서 산화가 일어납니다.
다만 충전지(충전기)나 전기분해 그리고 건전지 모두 anode는 산화전극, cathode는 환원전극입니다. 이것은 +와 -와 달리 전자의 이동 방향이 나가는 것은 산화로써 같기 때문입니다. 즉, 충전기나 전기분해에서는 +가 산화이므로 anode로 산화전극, 건전지에서는 -가 산화이므로 anode로 산화전극입니다.
anode(산화전극)와 cathode(환원전극)와 혼동하기 쉬운 anion은 음이온(-)이고, cation은 양이온(+) 입니다. 이것은 마찬가지로 전기분해나 화학전지에나 변함은 없습니다.
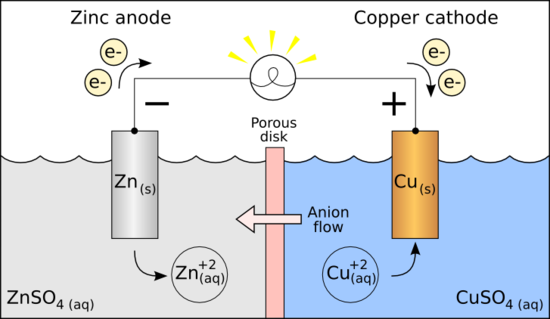
위의 그림은 갈바니전지(galvanic cell)의 대략적인 구조로써 화학전지의 일종입니다. 이온화경향이 큰 아연이 구리보다 산화되기 쉽고, 따라서 전자를 방출(이동)하므로 음극(-)이 됩니다.
-전극인 아연은 산화반응이 일어나므로 산화전극, +전극인 구리는 환원반응이 일어나므로 환원전극입니다. 이것이 전기분해일때는 서로 반대가 됩니다(제일 위의 그림 참고, 다만 anode나 cathode가 아닌 단지 +극와 -극의 차이로만 본다면.)
갈바니전지는 자발적인 산화와 환원을 이용하며 한번사용하면 다시 쓸수없는 1차전지이고, 충전과 방전을 모두 할 수 있는 니켈-카드뮴 또는 리튬이온전지는 2차전지입니다. 이것들을 화학전지라고 합니다.
산화와 환원반응을 통하여 화학에너지와 전기에너지를 서로 전환시키는 과정에는 화학전지와 전해전지가 있습니다.
화학전지(chemical cell) : 화학에너지 → 전기에너지. 일반적인 전지. 자발적반응. 수소의 연료전지(fuel cell)도 여기에 해당.
전해전지(electrolytic cell, 전기분해) : 전기에너지 → 화학에너지. 비자발적반응으로 전기에너지 필요.
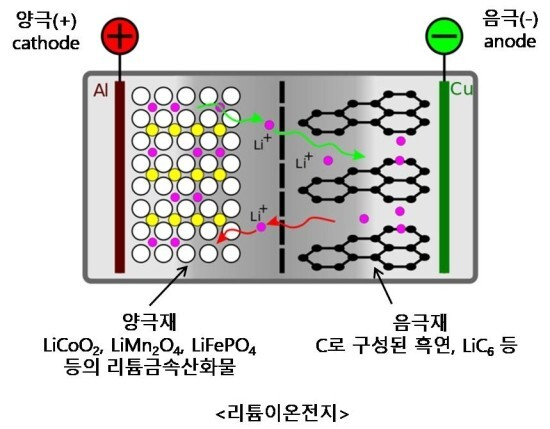
리튬이온전지(Lithium-ion battery)는 방전과정에서 리튬이온이 음극(-)에서 양극(+)으로 이동하며, 충전시에는 리튬이온이 양극(+)에서 음극(-)으로 다시 이동하여 원위치하게 됩니다. 구리(Cu)는 낮은 전위에서 안정하며, 알루미늄(Al)은 높은 전위에서 안정하므로 각각 구분하여 사용하고, 안정한 상태가 되지 않는다면 Li와 결합하여 합금을 형성할 수도 있습니다. 리튬이온전지의 경우 음극(anode)의 활동퍼텐셜전위는 0.5~2.5V이고, 양극(cathode)의 경우 3~4.7V입니다. 따라서 리튬과의 안정성을 유지하기위해 음극기재에는 구리(0.337V wrt Hydrogen 그리고 2.7V wrt lithium), 양극기재에는 알루미늄(1.662V wrt Hydrogen 그리고 4.7V wrt Lithium)이 집전장치로 사용됩니다(w.r.t. = with respect to ~).
사전적인 의미에서 애노드(anode)는 양극(+), 캐소드(cathode)는 음극(-)이지만,
양극재는 cathode materials, 음극재는 anode materials로 사용됩니다.
이것은 양극재와 음극재가 배터리와 같은 건전지를 기준으로 하기 때문에 이름 붙여진 것입니다.
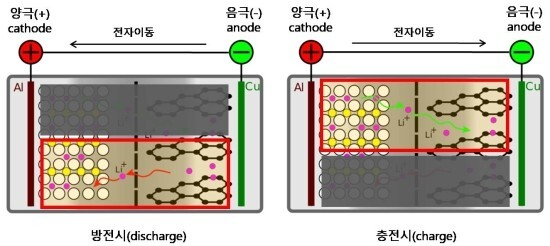
양극재(양극활물질)는 리튬의 공급원이 되고, 음극재(음극활물질)는 리튬을 충전 및 방전시키는 역할을 합니다. 리튬이온전지는 방전시(discharge)인 건전지를 기준으로 양극(cathode)과 음극(anode)으로 구성됩니다. 따라서 전류가 나가고 전자가 들어오는 상태가 캐소드라고 합니다. 하지만 충전시(charge)에는 전류와 전자의 방향이 바뀌므로 캐소드가 애노드가 되어야 하지만, 리튬이온전지에서는 변화가 없습니다. 따라서 2차전지의 경우는 캐소드와 애노드의 정의를 무시하고 임의대로 사용합니다. 이렇게하여 어느쪽이 +이고 어느쪽이 -인지를 언어적으로 구분하게 됩니다. 다만 물리적으로는 제일 위의 그림과 매커니즘이 같습니다
‘활물질’이란 ?
‘활물질(Active material)’이란, 배터리의 양극재와 음극재에서 화학적으로 반응하여 전기 에너지를 만들어 내는 활성 물질을 의미합니다. 양극재 속 활물질을 ‘양극 활물질’, 그리고 음극재 속 활물질을 ‘음극 활물질’이라 일컫습니다.

양극 활물질
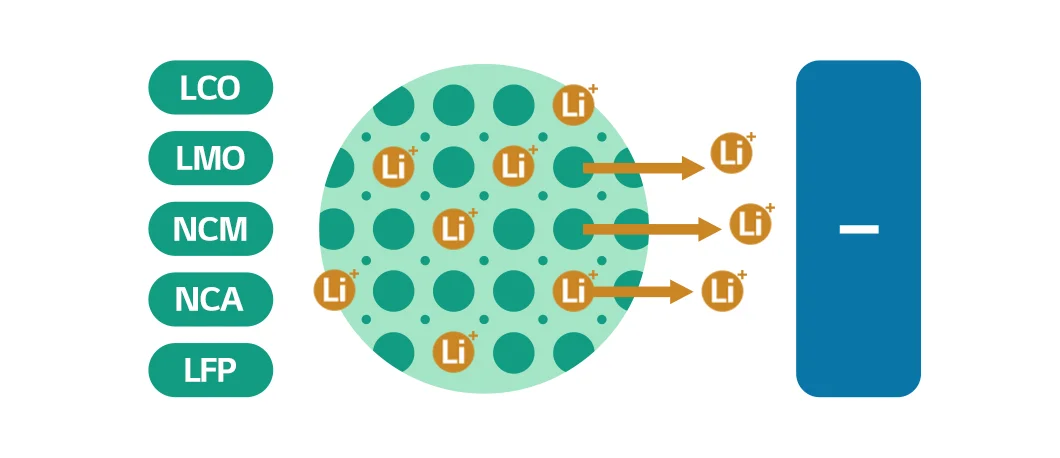
양극재에 있는 ‘양극 활물질’은 리튬 이온을 갖고 있다가 배터리를 충전할 때, 음극으로 리튬 이온을 제공하는 역할을 합니다. 양극 활물질은 배터리의 용량과 출력에 영향을 주는데요. LCO(리튬·코발트산화물), LMO(리튬·망간산화물), NCM(니켈·코발트·망간), NCA(니켈·코발트·알루미늄), LFP(리튬·인산철) 등 필요에 따라 각 물질의 특성을 조합하여 사용합니다.
음극 활물질
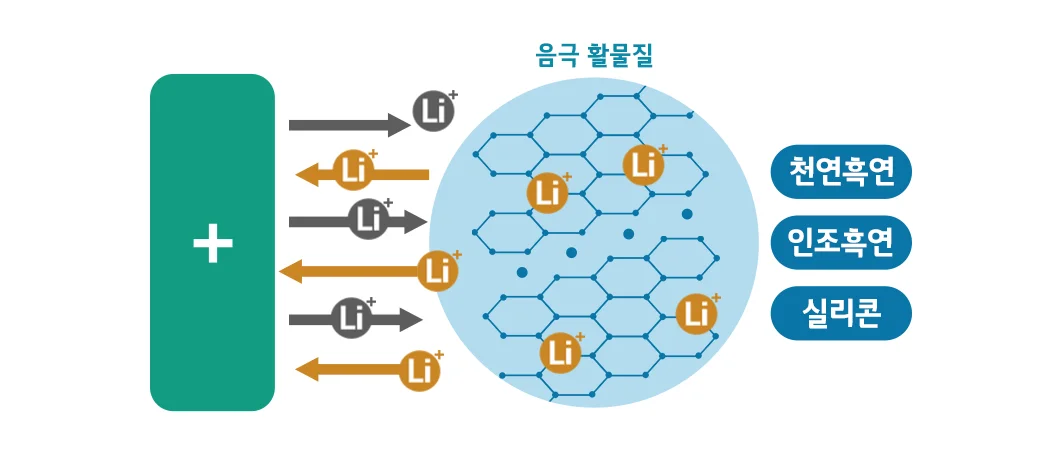
음극재 속 ‘음극 활물질’은 배터리 방전 시, 양극에서 이동해 온 리튬 이온을 저장 및 방출하여 전기 에너지를 발생시킵니다. 음극 활물질에는 리튬 이온의 이동(충·방전)에 안정적인 흑연이 주로 사용되고 있으며, 최근에는 음극재의 성능을 높이기 위해 흑연보다 에너지 밀도를 더 높일 수 있는 실리콘이 주목을 받고 있습니다.
배터리 제조에 반드시 필요한 요소인 만큼, 활물질 소재를 안정적으로 확보하는 것은 중요한 과제입니다.
리튬이온 배터리 활물질
양극재, 음극재, 분리막, 전해질이 리튬이온 배터리의 4대 요소로 불린다. 이 중 음극재와 양극재 속에 포함된 활물질은 배터리 내에서 전기를 일으키는 가장 근본이 되는 물질을 일컫는다.
양극활물질
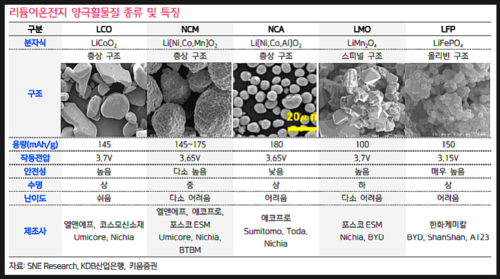
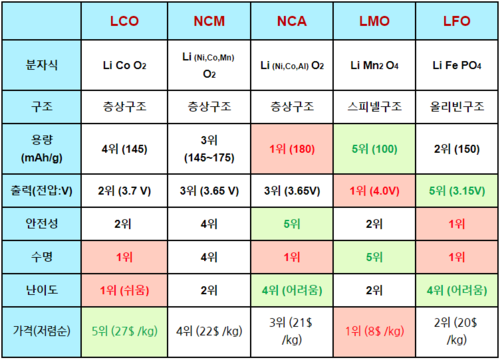
양극활물질은 리튬이온을 제공할 수 있는 물질이다. LCO(Lithium cobalt oxide), LMO(Lithium manganse oxide), LNO(Lithium Nickel oxide) 등이 주로 양극 활물질로 사용되며 각각의 특성을 조화시켜 만든 NCM(Ni, Co, Mn), NCA(Ni, Co, Al) 등이 실제 리튬이온배터리의 양극 활물질로 사용된다.
각 물질마다 특성이 다른데, 대표적인 세 물질의 특성은 다음과 같다.
LCO(LiCoO₂ - 리튬코발트산화물) : LiCoO₂는 구조적으로 밀집된 산소층 사이에 리튬과 코발트이온의 층이 교대로 존재하는 층상 암염 구조를 갖는다. 전통적으로 LiCoO₂는 높은 온도에서 오랜 시간동안의 고상 반응을 통해 합성되어 졌다.합성이 용이하고, 전기화학 성능이 우수하다(용량=274mAh/g). 현재 상용화되어 있는 리튬이온 배터리의 양극활 물질로 주로 사용되고 있다. 하지만 주원료인 Co 가격이 높다는 단점이 있다.
LMO (LiMn₂O₄ - 리튬망간산화물)ㅡ삼원계 : 구조적으로 스피넬 구조를 가지고 있는 리튬 망간산화물(LMO)은 용량이 100mAh/g으로 LCO보다는 낮다. 그러나 출력 특성이 좋고 안전성이 우수하며, 가격이 저렴하여 성능이 낮은 제품에 적용되고 있다.
LNO : 양극활물질 중에서 가장 고용량이다.
NCM(Li[NiCoMn]O₂ - 니켈코발트망간)ㅡ삼원계
NCA( Li[NiCoAl]O2 - 니켈코발트알루미늄)ㅡ삼원계
LFP( LiFePO4 - 리튬인산철)
Ni, Co, Mn를 주 성분으로 한 3성분 계 Ni-rich NCM 계 양극활물질은 LiNiO₂ (LNO)의 고용량, LiCoO₂ (LCO)의 우수한 전기화학 성능, LiMn₂O₄ (LMO)의 안정성의 장점을 고루 지닌다.
음극활물질
음극활물질은 양극에서 나온 리튬이온을 저장, 방출함으로써 전기를 발생시키는 역할을 하는 물질이다. 충전 시에는 음극에 리튬이온을 저장하고 있다가, 방전 시에는 리튬이온을 전해액을 통해 양극으로 이동시키게 되고, 리튬이온과 분리된 전자는 도선을 따라 이동하면서 전기가 발생한다.
음극활물질은 ① 원활한 이온전도율, ②리튬이온을 많이 저장할 수 있는 대용량과 큰 출력, ③긴 수명, ④구조적 안정성, ⑤낮은 전자 화학 반응성, ⑥저렴한 가격 등을 갖추고 있어야 한다.
음극은 구리 기재 위에 음극활물질, 도전제, 바인더가 입혀지는데, 음극에는 대부분 안정적인 구조를 지닌 흑연(Graphite)이 사용된다. 흑연은 음극 활물질이 지녀야 할 많은 조건들인 리튬이온을 많이 저장할 수 있는 대용량, 긴 수명 구조적 안정성, 낮은 전자 화학 반응성, 저렴한 가격 등을 갖춘 재료로 꼽히고 있다.
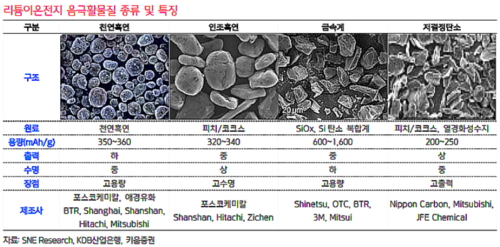
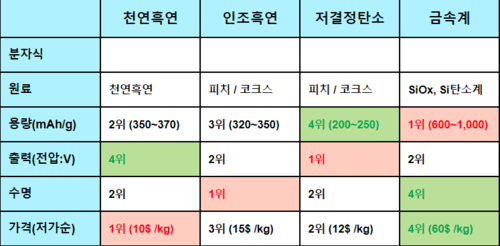
일반적으로 천연흑연이 사용되며 점차 인조흑연으로 대체하는 추세이다. 흑연 외에도 LTO(Lithium titanate), 그래핀(graphene), silica, TiO₂등의 음극 활물질로 사용할 수 있는 물질들이 존재한다.
흑연의 이론적 용량이 372mAh/g, TiO₂는 335mAh/g인 것에 비해 silica는 4200mAh/g으로 압도적으로 큰 용량을 가지고 있다. 하지만 순전히 silica로만 이루어진 음극은 사용할 수 없으며, 그 이유는 용량 유지율이 급격히 낮아지기 때문이다. 이를 보완하기 위해 소량의 silica를 첨가하는 식으로 음극의 용량을 향상시키고 있다.
'비지니스 & 기술 > 기타' 카테고리의 다른 글
| 잉곳 (Ingot)과 실리콘 (Silicon) (0) | 2022.11.04 |
|---|---|
| 전고체 배터리(全固體, solid-state battery) (0) | 2022.11.04 |
| Term Sheet & Due Diligence (0) | 2022.10.27 |
| 수소와 수소전기차에 관한 오해.."수소는 안전하다" (0) | 2022.10.26 |
| 중국 정부 및 행정기관 (1) | 2022.10.24 |